
2019-10-22
功能性胺基酸在豬免疫系統中的作用
胺基酸除了參與動物體生長之外還參與多種多樣的重要生理代謝過程,包括對機體免疫系統的調節。
在動物處於亞臨床疾病的狀況下,增加飼糧功能性胺基酸(即甲硫胺酸、色胺酸、羥丁胺酸、精胺酸、麩醯胺酸和甘胺酸)水準可彌補因機體免疫反應所造成的生長性能下降的負面影響。
John Htoo博士, Evonik nutrition & Care GmbH
摘要
- 胺基酸除了參與動物體生長之外還參與多種多樣的重要生理代謝過程,包括對機體免疫系統的調節。
- 在動物處於亞臨床疾病的狀況下,增加飼糧功能性胺基酸(即甲硫胺酸、色胺酸、羥丁胺酸、精胺酸、麩醯胺酸和甘胺酸)水準可彌補因機體免疫反應所造成的生長性能下降的負面影響。
- 現有的研究文獻指出,相對於健康動物日糧營養水準,提高功能性胺基酸的理想比例,如SID甲硫胺酸+胱胺酸:離胺酸(+6個百分點)、色胺酸:離胺酸(+3個百分點)和羥丁胺酸:離胺酸(+5個百分點)可以增強處於亞臨床疾病的豬體的免疫力並維持其生長性能。
- 提高亞臨床腸道感染豬的日糧中的羥丁胺酸、精胺酸、麩醯胺酸和甘胺酸的水準可有助於增強豬體的免疫力和維護腸道完整性。
- 需要進一步研究以評估功能性胺基酸對動物免疫功能的相互作用或協同作用。
前言
在商業農場,豬通常處在慢性亞臨床疾病和環境緊迫狀態之下,以致飼料採食量和生產性能下降。豬的健康或免疫力狀態的差異是導致商業養殖場間豬的生產力差異的原因之一(Pastorelli等,2012)。如要維持動物處於最佳的健康和生產力狀態,滿足動物對必須營養素,包括胺基酸的需求是必要的。免疫系統是動物體的防禦系統。入侵宿主的病原體借助動物體代謝增殖,導致消化道組織破壞,從而啟動免疫系統以清剿入侵的病原體。
胃腸道(GIT,從胃到結腸)是動物免疫系統的關鍵組成部分。除了消化和吸收營養物質的生理功能,腸細胞分泌的消化酶和激素發揮腸道免疫屏障作用。在談到腸道免疫時,重點關注斷奶仔豬,因為它們不成熟的消化和免疫能力與斷奶後腹瀉等腸道疾病的發病率有較高的相關性。2006年歐盟禁止在動物飼料中使用抗生素促生長劑(AGPs)後,動物的全身和腸道免疫的挑戰劇增。
飼料添加劑,包含各種各樣的益生菌、益生元、有機酸、精油、植物提取物、酶和抗生素(某些國家)以及胺基酸,被嘗試增強動物的免疫力。一些功能性胺基酸參與動物免疫功能是通過調節1)T淋巴細胞、B淋巴細胞、自然殺傷細胞和巨噬細胞的活化,(2)細胞氧化還原狀態和基因表達,以及(3)抗體、細胞因數和其他細胞毒素的產生(Li等,2007)。在免疫系統刺激(ISS)過程中,用於生長的營養物質被轉移至參與免疫應答的組織和器官(Reeds和Jahoor,2001)。這意味著生產參與免疫應答的物質需要更多的關鍵胺基酸。因此,提高日糧功能性胺基酸水準是維持腸道健康和促進生長的可能的解決方案之一,因為這些胺基酸可以提高斷奶仔豬免疫系統的應達能力和維護腸道完整性。當斷奶仔豬處在糟糕的衛生和環境條件且日糧不包含AGPs時,功能性胺基酸所發揮的作用將顯得尤為重要。
本文旨在綜述豬的免疫系統,功能性胺基酸在免疫系統中的作用,以及它們在免疫刺激條件下促進免疫力的應用性。有關胺基酸對動物免疫功能的影響的更深入的綜述,請參見li等(2007)和Wu(2010)。
豬的免疫系統
免疫系統是動物體內的疾病防禦體系,可以靈敏檢測並精准除滅侵入動物體內的病毒、細菌、真菌和寄生蟲等病原微生物(Kuby,1994)。動物免疫系統有兩個免疫子系統:先天性(非特異性)免疫和獲得性(特異性)免疫(圖1)。
圖1
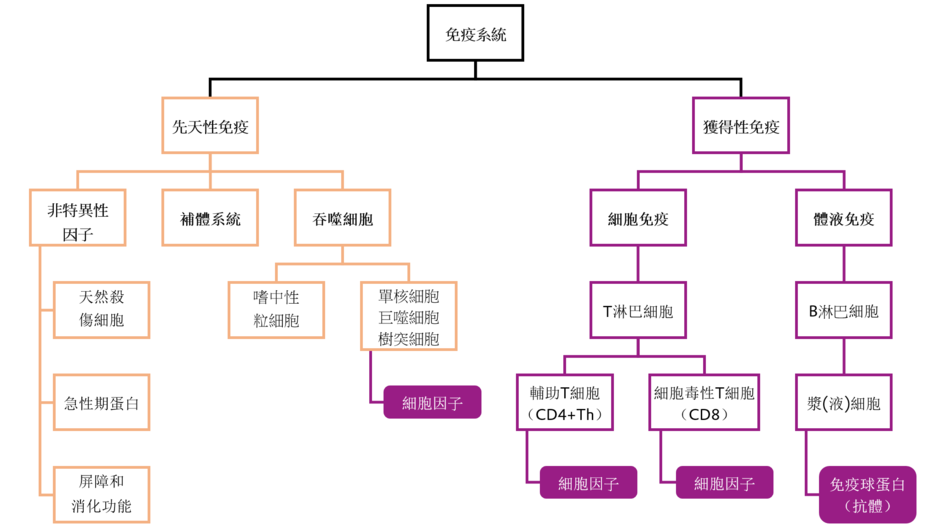
先天性免疫是動物與生俱來的、對侵入病原體進行最初始的基本防禦。先天性免疫通過物理(皮膚)、生理反應(溫度、pH值、氧氣張力)、噬菌作用(巨噬細胞攝取大分子)和炎症反應四層屏障來分層抵禦病原體入侵(Kuby,1994)。先天性免疫是通過細胞(單核細胞、巨噬細胞、樹突狀細胞、中性粒細胞、自然殺傷細胞)和外細胞介質(細胞因數、趨化因數、急性期蛋白、補體系統、上皮屏障和抗菌肽)履行其免疫功能(Parkin和Cohen,2001;Tan人,2013)。
獲得性免疫是經由天然的或接種疫苗接觸抗原而誘發的,其免疫過程發展比較緩慢(Kuby,1994)。獲得性免疫系統可分為體液免疫和細胞免疫。在體液免疫應答過程中,血液中的B淋巴細胞分泌免疫球蛋白(抗體)以結合和中和外來抗原(Parkin和Cohen,2001)。細胞介導的免疫功能是T細胞(T淋巴細胞)及其相關細胞因數相互作用以消除細胞內抗原。兩種主要類型的T細胞是輔助性T細胞(CD4+Th)和細胞毒性T細胞(CD8+)。CD4+Th細胞識別外來抗原並協助其他細胞消滅病原體。CD8+細胞毒性細胞參與抗病毒和抗腫瘤活性(Parkin和Cohen,2001)。
腸道免疫
胃腸道(GIT),即從胃到結腸部分,是動物體免疫系統的重要組成部分,因為它擁有超過1012淋巴細胞,抗體濃度高過體內任何其它器官和組織(Mayer,2000)。除了消化、吸收和代謝營養素外,小腸上皮細胞(腸細胞)分泌消化酶和激素構建起了動物與外部環境(如食物營養素、微生物、病原體和有毒物質)聯繫的介面,起到免疫屏障的作用(Stoll和Burrin,2006)。胃腸道也是各種微生物的棲息地,它們在此利用間或合成營養物質。因此,胃腸道是動物體代謝最為活躍並最為複雜的組織器官之一。
小腸上皮細胞通過分泌粘液和抗菌肽執行胃腸道先天性免疫功能(Shao等,2001)。粘液的主要組成成分是粘蛋白,是由沿胃腸道上皮分細胞分泌的糖基化的蛋白質,起到保護腸壁免受損傷和維持免疫功能(Li等,2007)。
腸上皮細胞分泌的抗菌肽(防禦素和凱薩林肽)和免疫球蛋白協同限制潛在病原體作用於腸粘膜(Oswald,2006)。此外,腸上皮細胞可產生細胞活化素,如白細胞介素IL-1、IL-10、IL-2和IL-18以及趨化因數,它們對免疫細胞的聚集與活化至關重要(Stadnyk,2002)。
在討論腸道免疫時將斷奶仔豬聯繫在一起是因為斷奶仔豬的消化道尚未發育完全,比成年豬更易受病原體侵襲及其免疫緊迫。母豬的初乳中的抗體是新生仔豬免疫保護的首要來源。新生仔豬的免疫系統在4周齡之前還未成熟(Blecha,2001)。目前,商業養豬場在仔豬3-4周齡時為其斷奶。斷奶後的頭幾天是仔豬承受巨大壓力的時間,通常伴隨著飼料攝入下降、生長遲滯和腸道屏障功能受損,再加之功能尚未成熟的消化和免疫系統從而使腹瀉發生的機率大大增加(Pluske等,1997;Moeser等,2007)。
因此,腸道免疫系統發育和維持不僅關係到斷奶仔豬的先天性的免疫防禦,而且關乎到整個免疫系統的發育、成熟和後期的生產性能。
免疫刺激轉變營養素利用途徑
在商業農場,處於亞臨床疾病狀態的豬的飼料利用率和生產性能要比飼養在良好條件下的豬要更低(Colditz,2002)。Pastorelli等2012)綜述報導,免疫刺激,特別是胃腸道細菌感染,使生長豬的體增重下降40%,其部分地歸因於採食量下降。而採食量和體重下降則與全身炎症相關。全身炎症是由先天性免疫系統釋放的促炎細胞因數引發的(Li等,2007)。在免疫系統受到刺激時,巨噬細胞產生的促炎症細胞因數,特別是IL-1β、IL-6和腫瘤壞死因數-α(TNF- α)改變了營養利用途徑,直接對肝臟、大腦、肌肉和脂肪組織產生影響(Colditz,2002)。
在免疫系統刺激(ISS)期間,用於生長的營養物質被轉移至參與免疫應答的組織和器官(Reeds和Jahoor,2001)。在此狀況下,肝臟成為合成全身蛋白質的主要器官,即犧牲肌肉和其它結構性蛋白質轉而增加合成大量的急性期蛋白(APP)。豬的主要急性期蛋白包括結合珠蛋白、纖維蛋白原、C-反應蛋白、血清澱粉樣蛋白A和其它豬急性期蛋白及白蛋白(Chen等,2003)。這些在蛋白質合成的類型和速率上的變化將直接影響組織器官對胺基酸(AA)的品質和數量需求(Reeds和Jahoor,2001;Obled,2003)。
免疫細胞利用胺基酸來維持克隆增殖,但更重要的是,肝臟也需要胺基酸來進行糖異生以及急性期蛋白和谷胱甘肽的合成,這些是免疫功能所必需的(Hunter and Grimble,1994;Reeds and Jahoor,2001)。動物的免疫力很大程度上取決於合成這些蛋白質和肽類所需的胺基酸和其它底物的可用性(Li等,2007)。免疫功能所需的胺基酸構成與肌肉蛋白的不同(Reeds和Jahoor,2001)。在免疫系統刺激(ISS)期間,因生長豬的第一限制胺基酸離胺酸通常會相對過量,因而免疫細胞所需的其它胺基酸(如甲硫胺酸+半胱胺酸、麩醯胺酸、色胺酸和羥丁胺酸)則成為限制性胺基酸(Reeds和Jahoor,2001)。
因此,滿足免疫功能所需的胺基酸並不同於滿足最佳生長性能所需的。在免疫系統刺激(如:亞臨床疾病狀態)期間,滿足維持良好免疫力所需的胺基酸將會緩解免疫系統刺激對動物生產性能的負面影響,從而提高生產效率。
功能性胺基酸在免疫系統中發揮的作用
除了作為蛋白質合成的基本構件,胺基酸還參與動物體內重要的代謝途徑。調節代謝途徑以改善動物健康、生存、生長、發育、哺乳和繁殖的胺基酸被定義為功能性胺基酸(Wu,2009)。
事實上,功能性胺基酸不同程度地參與調節胃腸道、胸腺、脾臟和淋巴等組織器官以及血液中免疫細胞的免疫功能(Cunningham-Rundles,2002)。總的來說,胺基酸影響免疫系統是通過增強動物機體免疫力來緩解或消除炎症和自身免疫等感染(Yoneda等人,2009)。自從歐盟禁止AGPs以來,功能性胺基酸在免疫系統中的作用越來越受到重視。
最重要的功能性胺基酸包括含硫胺基酸,即甲硫胺酸和半胱胺酸、色胺酸、羥丁胺酸、麩醯胺酸、精胺酸和甘胺酸(Li等,2007)。下面將著重論述功能性胺基酸作為動物,特別是豬飼糧添加劑所發揮的作用和有益效果。
含硫胺基酸
甲硫胺酸是必需的胺基酸,然而半胱胺酸則是非必需胺基酸,因為其可經由甲硫胺酸代謝途徑合成,但不可逆代謝途徑合成甲硫胺酸。甲硫胺酸是重要生物分子甲基化過程,如DNA甲基化和多胺合成等的甲基供體(Grimble,2002),這與免疫系統受到刺激時免疫細胞的增殖緊密相關(Dwyer,1979)。半胱胺酸是合成谷胱甘肽(GSH)的限速性的底物,而谷胱甘肽,由谷胺酸三肽、半胱胺酸和甘胺酸構成,是重要的細胞內抗氧化劑(Wu等,2004)。谷胱甘肽在細胞內以還原型(GHS)和二硫化物氧化型(GSSG)形式存在,還原型與氧化型的比值(GSH:GSSG)反映細胞內的氧化還原態勢(Roth,2007)。GSH:GSSG比值升高則表明細胞免疫狀態得到改善,因為GSH:GSSG比值降低與細胞氧化緊迫(Fang等,2002)和豬腸道萎縮(Wang等,2008)相關。
除了作為自由基和其他活性氧類物質(ROS)的清除劑外,谷胱甘肽還直接參與免疫功能,因為它是啟動T淋巴細胞和白細胞以及產生細胞因數所必需的(Lu,2009;Wu等,2004)。
半胱胺酸是代謝產生牛磺酸的必需物質。牛磺酸的生物功能是穩定細胞膜和抗氧化(Grimble,2002),其極為豐富地存在於白細胞中(Roth,2007)。在注射松節油刺激免疫系統的豬,纖維蛋白原(一種含有約4%半胱胺酸的急性期蛋白)的合成速度增加約140%(Jahoor等,1999)。
在免疫系統緊迫過程中,半胱胺酸用於生成與免疫反應相關的化合物(如:GSH、牛磺酸和急性期蛋白)的利用率增加(Grinble,2002)。這意味著在免疫系統受到刺激的情況下,對甲硫胺酸和半胱胺酸的需求會增加。下面將論述如何更有效地補充甲硫胺酸以滿足動物對含硫胺基酸(Met+Cys)的需求。
Rakhshandeh等(2010)報導,通過注射來自大腸桿菌細胞壁的脂多糖(LPS)引起的免疫系統刺激沒有明顯地影響胺基酸和能量在回腸末端的消化率。然而,脂多糖刺激降低了整體氮與硫(N:S)比例,表明動物優先貯存含硫胺基酸,而非生產諸如谷胱甘肽等非蛋白化合物,以提高免疫力。Rakhshandeh等(2014)的另一項研究發現,免疫系統刺激降低了體蛋白質沉積和每日的含硫胺基酸的需求(圖2),但增加了含硫胺基酸的維持需要:例如,為實現恒定的每日50g蛋白質的沉積,未受免疫系統刺激(ISS-)的豬需攝入SID含硫胺基酸1.63 g,而受到免疫系統刺激(ISS+)的豬每日則需要攝入1.87 g(即增加15%)。
圖2
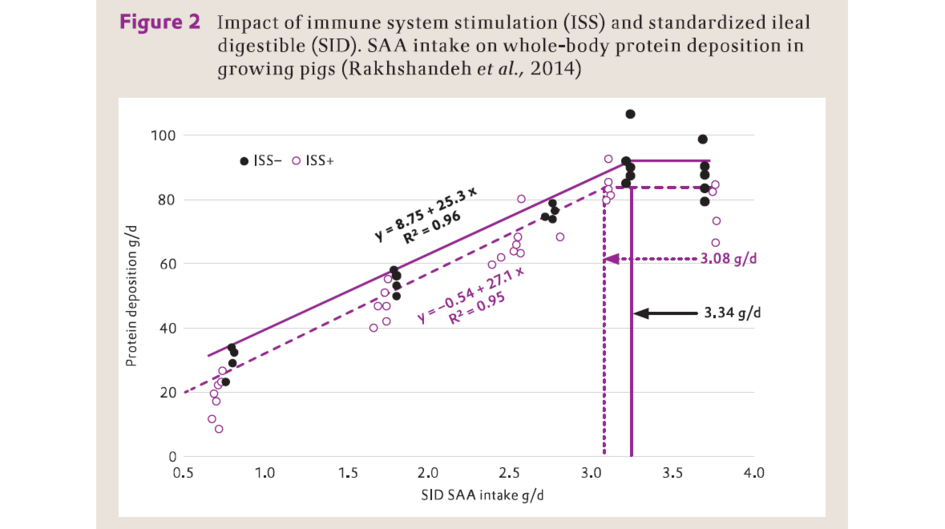
免疫系統刺激(ISS)和標準回腸可消化(SID)胺基酸攝入量對生長豬體蛋白沉積的影響(Rakhshandeh 等,2014)
Protein deposition (g/d) – 蛋白質沉積 (g/d)
SID SAA intake (g/d) – 標準回腸可消化含硫胺基酸 (g/d)
當由脂多糖激發免疫刺激的豬採食低水準Met+Cys飼料時,其血漿白蛋白的濃度及其合成分速率降低(Litvak等,2013a)。Litvak等(2013b)在生長豬氮平衡試驗的結果表明,注射脂多糖引發的免疫系統刺激降低了蛋白質沉積率,而且獲得最大體蛋白沉積的最佳飼糧Met對Met+Cys比率從57增加到59%(圖3)。
圖3
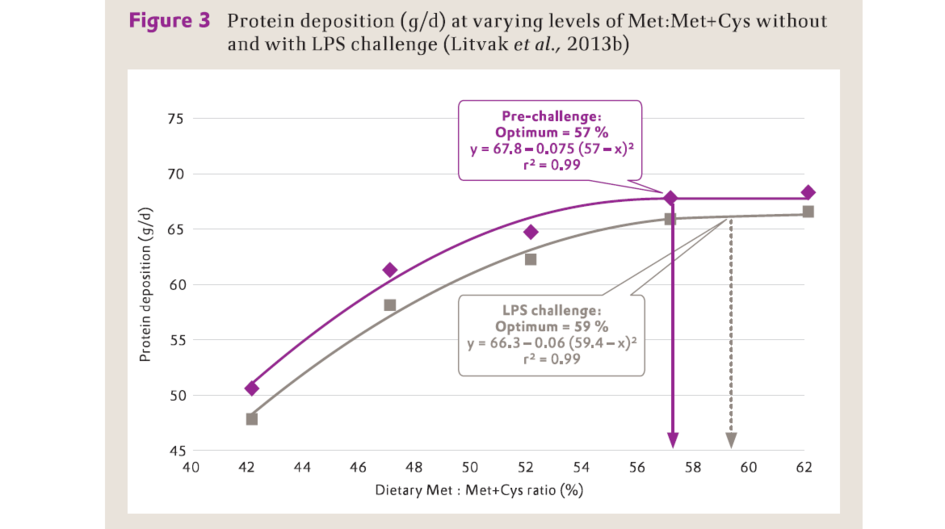
日糧含硫胺基酸(Met+Cys)中的甲硫胺酸水準對脂多糖誘導免疫反應的豬體蛋白沉積的影響(Litvak等,2013b)
Protein deposition (g/d) – 蛋白質沉積 (g/d)
Dietary Met:Met+Cys ratio (%) – 日糧甲硫胺酸:甲硫胺酸+半胱胺酸比率(%)
Pre-challenge: Optimum = 57% - 免疫刺激前:最適比率 = 57%
LPS challenge: Optimum = 59% - 脂多糖刺激:最適比率 = 59%
這說明處於免疫系統刺激狀態的動物因產生谷胱甘肽而增加的對Met+Cys需要最好是通過補充甲硫胺酸來滿足,而非半胱胺酸。因為,半胱胺酸極不穩定,易迅速地被氧化成胱胺酸並產生自由基。自由基對動物細胞極具破壞力(Grimble,2002)。
由於這些細胞毒性,半胱胺酸主要以二肽(胱胺酸)貯存於細胞外液中。然而,還原型的半胱胺酸在細胞內水準只維持滿足諸如蛋白質和GSH合成等基本功能所需(Stipanuk和Ueki,2011)。
當生長豬由脂多糖引發免疫反應時,其獲得最大體蛋白質沉積所需的日糧SID Met+Cys:Lys比率從55%增加到75%(Kim等,2012)。在商業化飼養條件下(即在飼喂無抗生素飼糧極易感染病菌),25~50公斤豬獲得最高生產性能的日糧SID Met+Cys:Lys比率為62.3%(Zhang等,2015;表1),明顯高於當前NRC(2012)推薦的56%。

這一結果與Capozzalo等的試驗結果相一致(2014),該試驗表明,感染大腸桿菌並飼喂無抗生素日糧的8-20公斤豬的體增重和飼料轉化率(FCR)最優,當其日糧SID Met+Cys :Lys比率為62.2%。
這些結果表明,動物處於免疫刺激狀態增加Met+Cys的需求,包括轉化為Cys所需的Met。
色胺酸
色胺酸除了參與蛋白質合成和5-羥色胺調節外,其還通過犬尿胺酸代謝途徑調控免疫功能。該代謝途徑由兩個關鍵酶,色胺酸2,3-雙加氧酶(TDO)和吲哚胺-2,3-雙加氧酶(IDO)啟動。TDO調控肝臟內血漿色胺酸濃度的穩定性。然而,IDO存在於多種組織器官(胃、小腸、肺和大腦)和巨噬細胞中,是在免疫系統受到刺激時由炎性細胞因數IFN-γ誘導產生(Widner等,2000)。超過95%的未被用於蛋白質合成的飼糧色胺酸經犬尿酸代謝途徑被分解並產生諸如犬尿酸和煙酸等多種代謝產物(Botting,1995)。
多個研究表明,與配對餵養的健康仔豬對比,肺部發炎降低豬血漿中色胺酸濃度(Melchior等,2004;圖4),且增加肺和相關淋巴結中的IDO活性(Le Floc'h等,2008)。
圖4
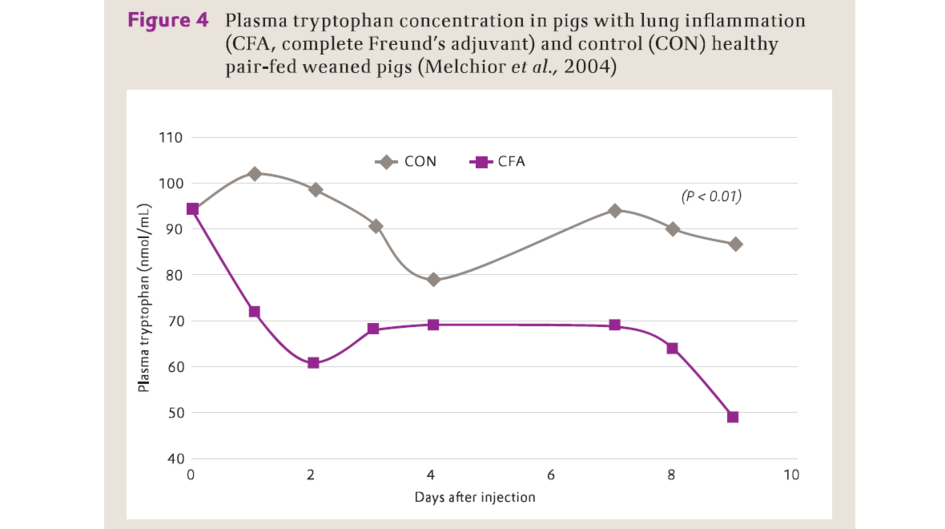
完全弗氏佐劑誘導肺炎對斷奶仔豬血漿色胺酸濃度的影響(Melchior等,2004)
Plasma tryptophan (nmol/mL) – 血漿色胺酸(nmol/mL)
Days after injection – 注射後天數
CON – 對照
CFA – 完全費氏佐劑
此外,這些研究者觀察到,餵食低水準色胺酸日糧的仔豬血漿主要急性期蛋白結合珠蛋白的濃度(其色胺酸含量相對較高)高於餵食正常水準色胺酸日糧的仔豬。這些結果表明,在免疫系統刺激狀態下,仔豬增加色胺酸經犬尿酸代謝途徑分解以便合成急性期蛋白。這預示,在仔豬處於免疫系統刺激狀態下,提高日糧色胺酸水準或許能維持其生長性能。此外,色胺酸可被代謝生成神經激素褪黑激素,其抗氧化性能可清除動物體內的自由基(Le Floc’h和Seve,2007)。
豬被飼養在惡劣的衛生條件下,會引起豬體產生中度的炎症反應。Le Floc'h等(2007)報導,在與飼養在良好衛生條件下的斷奶豬相比,當飼養在惡劣衛生條件下的斷奶仔豬採食較高水準的SID Trp:Lys日糧(21 vs. 18%)時,其獲得最優的採食量和體增重(圖5)。
圖5
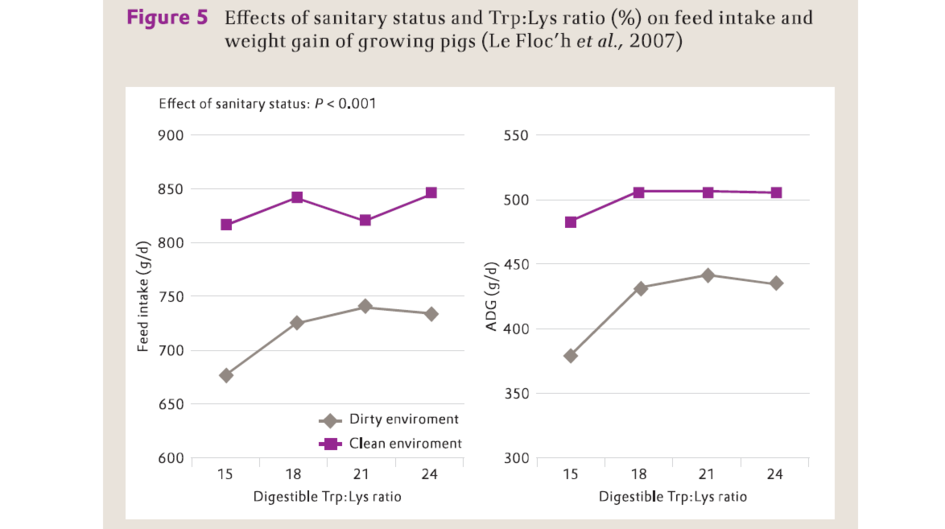
衛生狀況和色胺酸:離胺酸水準對生長豬採食量及其體增重的影響 (Le Floc’h等,2007)
Feed intake (g/d) – 採食量(g/d)
ADG (g/d) – 平均日增重(g/d)
Digestible Trp:Lys ratio – 可消化色胺酸:離胺酸比率
Dirty environment - 骯髒環境
Clean environment – 清潔環境
在免疫系統刺激期,由於大量的色胺酸被轉移用於應對免疫反應,致使生長豬體蛋白質沉積率降低。因此,提高日糧色胺酸水準+7%以獲得與健康豬相同的體蛋白質沉積(de Ridder等,2012)。
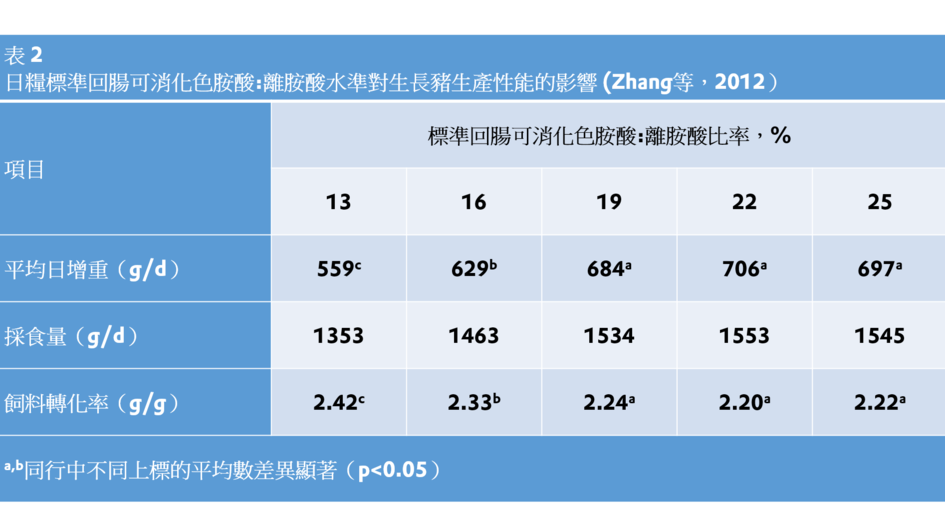
在不含任何抗生素的日糧中添加較高水準的色胺酸(22% SID Trp:Lys)使商業化飼養的生長豬(20-50 kg)獲得最大的生產性能(Zhang等,2012;表2)。
最近,Jayaraman等(2015)報導,大腸桿菌K88促炎症細胞因數TNF-α的mRNA在受感染斷奶仔豬的回腸組織中的表達隨著日糧SID Trp:Lys水準的增加而呈線性下降。豬在飼喂平均SID Trp:Lys 為22.6 %的日糧獲得最優的生產性能。這與Capozzalo等2015)的結論一致。
該試驗顯示,日糧SID Trp:Lys水準增加到24%改善了採食無抗生素日糧斷奶仔豬的飼糧轉化率(FCR)以及提高了血漿色胺酸和犬尿酸水準,這與斷奶仔豬是否感染大腸桿菌無關。在飼養在商業農場並飼喂無抗生素飼糧的條件下,斷奶豬基本處於亞臨床疾病狀態,提高飼料SID Trp:Lys比水準至24 %會提高斷奶仔豬體增重、改善飼料轉化效率(Capozzalo等,2013)。
羥丁胺酸
羥丁胺酸參與合成免疫球蛋白(即抗體),因而其在促進動物機體免疫反應能力發揮著至關重要作用。羥丁胺酸是免疫球蛋白最豐富胺基酸(占牛奶免疫球蛋白約10%;Bowland,1966)。超過60%的羥丁胺酸在豬的門靜脈徑流臟器(PDV;包括小腸、大腸、胃、胰腺和脾臟)被首過代謝(Stol等,1998)。確實,與經口飼喂的仔豬相比,繞過腸道飼喂的仔豬(即繞過PDV首過代謝)對羥丁胺酸的需要量下降了55%(Bertolo等,1998)。
在胃腸道合成的粘膜蛋白包括分泌到腸腔的粘液蛋白,其防護腸道免受損傷和病原體侵害。粘液蛋白富含羥丁胺酸,約占粘液蛋白總胺基酸的30%,回腸內容物總內源性蛋白質的11%(Lien等,1997)。粘液蛋白的生成和分泌是連續不斷的,且抵禦消化酶的分解,因其含有高濃度的O-連接寡聚糖(Strous和Dekker,1992)。這意味著增加的粘液分泌將直接增加胺基酸,特別是蒜胺酸的內源性損失。因此,羥丁胺酸維持胃腸道完整性和免疫力的關鍵胺基酸。
Cuaron等(1984)試驗證明,飼喂以高粱為基礎的,但含充分羥丁胺酸飼糧的母豬血漿IgG含量高出飼喂羥丁胺酸缺乏飼糧的產子期母豬20%。在懷孕期母豬低蛋白飼糧中補充0.14 %L-羥丁胺酸增加了產仔時和哺乳期間乳中IgG濃度(Hsu等,2001)。
此外,補充L-羥丁胺酸以提高已能滿足最優生長飼糧羥丁胺酸水準(Thr:Lys比達99%),提高了注射牛血清白蛋白的17-31公斤豬的血清白蛋白IgG和牛血清白蛋白抗體的產生(Li等,1999)。相類似的,Wang等(2006)報導,注射卵清蛋白的10-25公斤的豬血清IgG濃度在飼糧SID Thr:Lys水準為78%達到最高,而其最優生性能在飼糧SID Thr:Lys水準為69%實現(圖6)。
圖6
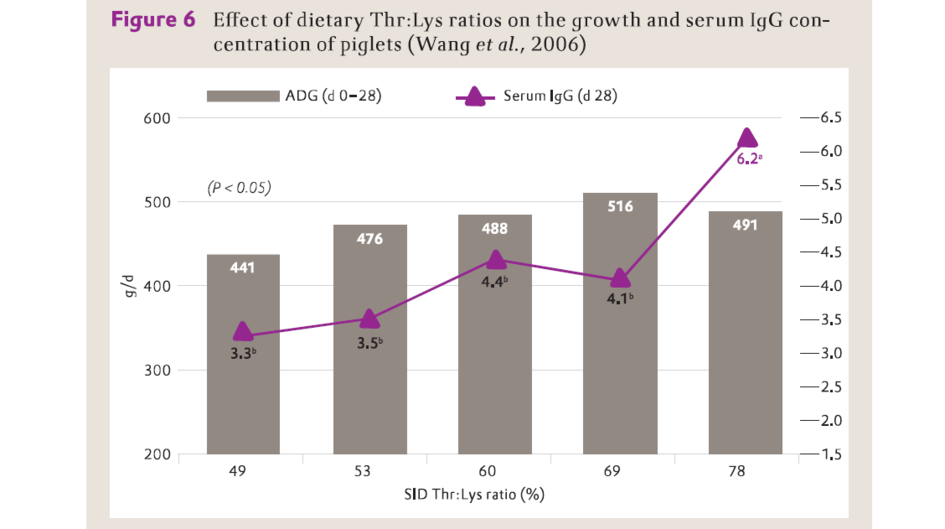
日糧羥丁胺酸:離胺酸水準對仔豬生長和血清免疫球蛋白(IgG)濃度的影響(Wang等,2006)
g/d – g/d
SID Thr:Lys ratio (%) – 標準回腸可消化羥丁胺酸:離胺酸比率(%)
ADG (d 0-28) – 平均日增重(0-28 d)
Serum IgG (d 28)– 血清IgG(28 d)
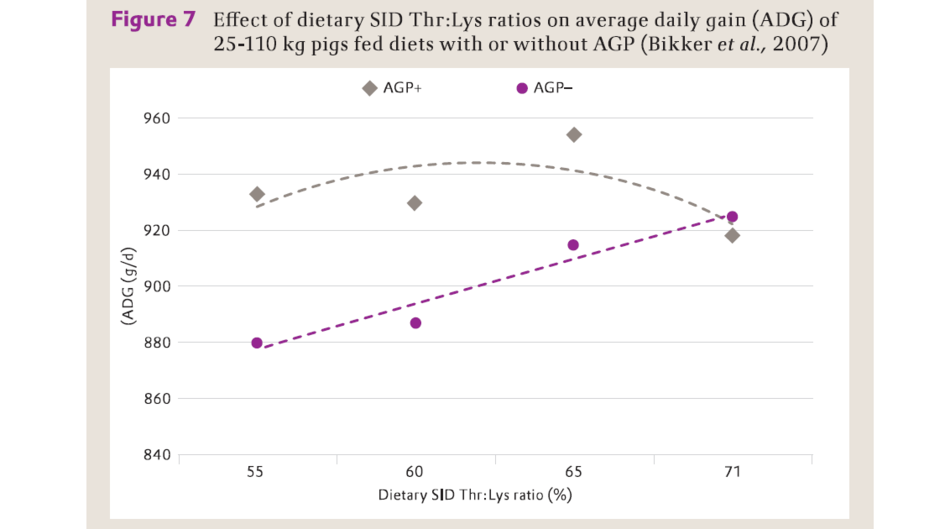
這些結果表明,羥丁胺酸是通過參與合成免疫球蛋白來調節免疫功能。養殖場衛生條件會影響動物的健康或免疫反應力。事實上,Bikkk等,(2007)的研究報告指明,飼喂無抗飼糧的25-110公斤豬在日糧SID Thr:Lys水準為71%的體增重高於添加了抗菌促生長劑(AGP)飼糧的豬,其在日糧SID Thr:Lys水準為65%獲得最優體增重(圖7)。Jayaraman等(2014)還報導,儘管差的衛生條件降低了生長速度,但將日糧SID Thr:Lys水準提高至71%改善了飼喂無抗飼糧仔豬的飼料轉化率。
圖7
日糧羥丁胺酸供給不足會增加仔豬的腹瀉發生機率,減輕粘膜重量,減少粘液在胃腸道的分泌量(Law等,2007),降低絨毛高度及其絨毛高度與隱窩深度比(Hamard等,2007)。Wang等(2007)發現,當飼喂適當羥丁胺酸水準(0.74% SID Thr)飼糧,斷奶仔豬空腸粘膜和粘液蛋白的合成分速率(FSR)高於飼喂過高水準(1.11% SID Thr)或過低水準(0.37% SID Thr)的飼糧。
與飼喂以酪蛋白為基礎飼料相比較,飼喂以高纖維(半纖維素)麩皮和大麥為基礎飼糧顯著增加生長豬內源性羥丁胺酸損失(Myre等,2008)。隨著飼糧中可食性果膠(可溶性纖維)增加,飼喂羥丁胺酸限制性飼糧的豬體蛋白沉積降低程度明顯高於飼喂離胺酸限制性飼糧,這主要歸因於內源性羥丁胺酸損失增加(Zhu等,2005)。
最近,Mathai等(2015)報導,飼喂高纖維日糧(含15%大豆皮)的25-50 kg豬獲得最優日增重所需的SID Thr:Lys為71%高於飼喂低纖維日糧的66%。飼喂高纖維日糧的豬的N沉積低於飼喂低纖維日糧的豬,表明豬採食高纖維飼糧增加的羥丁胺酸需要量用於合成粘蛋白多於用於體生長。
麩醯胺酸
麩醯胺酸(Gln)是哺乳動物體內和乳汁中最豐富的游離胺基酸(Wu等,1996)。除了作為快速分裂細胞,如小腸細胞和白細胞等,的主要能量來源外,麩醯胺酸還參與諸多如糖原異生、器官間氮轉移、免疫應答和細胞氧化還原狀態等代謝過程的調節(Wu等,2007)。由於麩醯胺酸與谷胺酸存在廣泛的相互轉化,谷胺酸(Glu)在包括合成ATP、精胺酸、鳥胺酸、瓜胺酸、丙胺酸、脯胺酸和天冬胺酸等途徑可以部分地取代麩醯胺酸(Reeds等,1997;Wu,1998)。
作為谷胺酸的前體,麩醯胺酸在谷胱甘肽的合成中發揮作用(Reeds等,1997)。谷氨醯胺也是合成核苷酸(嘌呤和嘧啶)的前體。核苷酸對淋巴細胞和粘膜細胞的增殖至關重要(Wu,1998)。小腸在首過代謝過程中消耗大約70%的攝取麩醯胺酸,僅30%進入腸腔的麩醯胺酸進入門靜脈血液池(Stoll和Burrin,2006),充分說明麩醯胺酸在維持腸道屏障的完整性和免疫功能方面發揮著極為重要的作用。
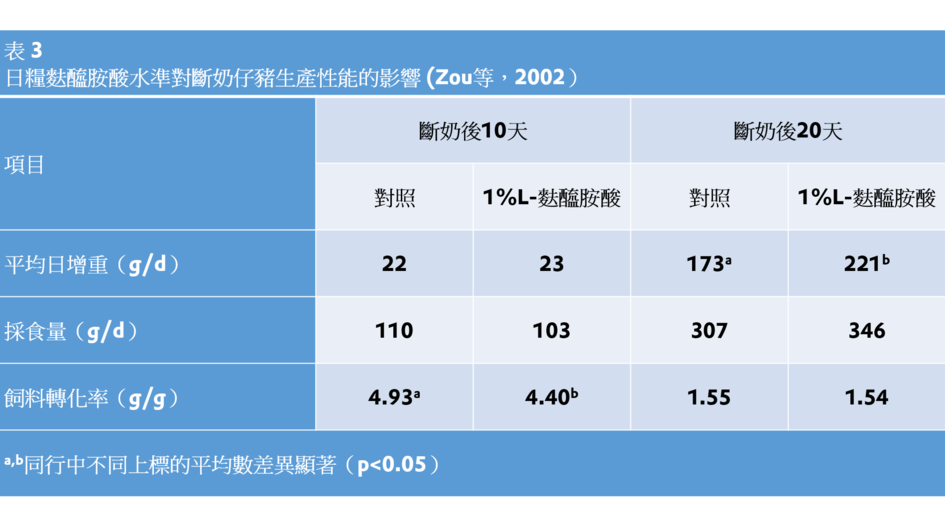
在日糧中補充4%的L-麩醯胺酸,增加了受大腸桿菌感染的早期斷奶仔豬白細胞計數並增強了淋巴細胞功能(Yoo等,1997)。在適當胺基酸水準的斷奶仔豬飼糧補充1%L-麩醯胺酸,使空腸絨毛高度增加並且飼料轉化效率得到改善(Wu等,1996)。Liu等(2002)也報導,在營養充分的飼糧中補充1%L-麩醯胺酸或L-谷胺酸,增加了斷奶仔豬空腸絨毛的高度。在充分的胺基酸營養水準的飼糧中補充1%麩醯胺酸提高了斷奶仔豬體增重和改善飼料利用效率(de Abreu等,2010)。Zou等(2006)報導,補充1%L-麩醯胺酸降低了斷奶仔豬腹瀉發生機率,提高了其生長性能(表3)。
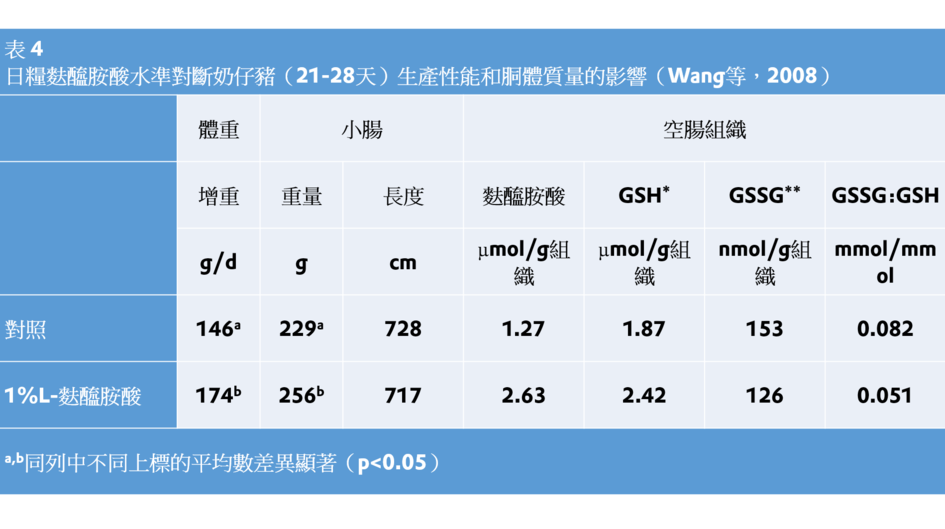
相同地,補充1%L-麩醯胺酸降低了抗氧化緊迫基因在腸道組織的表達,並增加了斷奶仔豬腸道谷胱甘肽的濃度、促進了小腸生長和體增重(Wang等,2008;表4)。
在日糧中添加0.8%50:50的麩醯胺酸和谷胺酸增加了斷奶仔豬的小腸絨毛高度和體重(Molino等,2012)。
精胺酸
精胺酸是合成一氧化氮(NO)、鳥胺酸、瓜胺酸、脯胺酸、谷胺酸、肌酸和多胺等重要生物活性分子的前體(Wu和Morris,1998)。精胺酸對動物機體免疫功能的調節作用是通過其代謝產物NO調控B細胞產生抗體和T細胞受體表達來實現的(de Jonge等,2002)。精胺酸的抗氧化功能可抵禦脂肪的過氧化作用(Galli,2007)。同時,精胺酸通過尿素迴圈解除氨在動物機體內的毒性作用(Visek,1986)。此外,精胺酸通過仔豬小腸和骨骼肌中的哺乳動物雷帕黴素靶蛋白(mTOR)信號通路啟動合成體蛋白(Yao等,2008)。
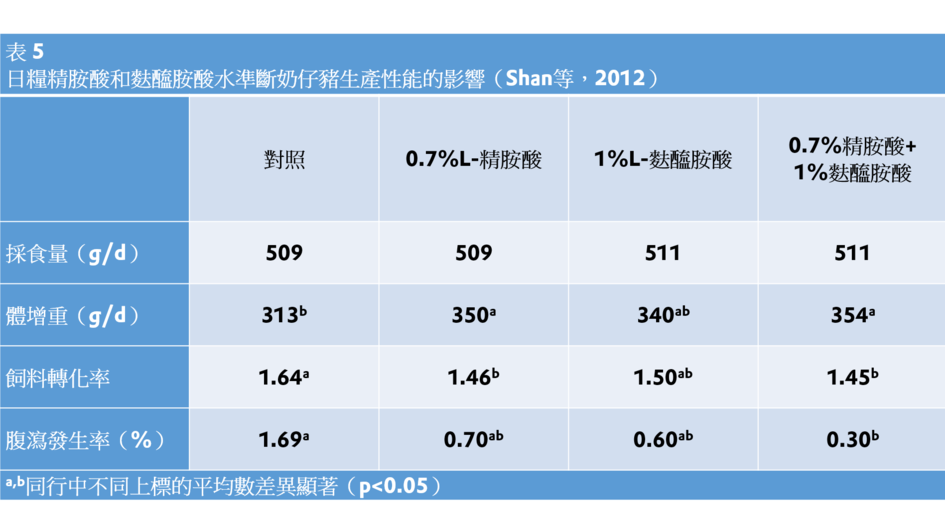
在飼糧中補充L-精胺酸增強了仔豬的免疫力、提高飼料利用效率(Tan等,2009a)以及妊娠母豬的免疫力(Kim等,2006)。在胺基酸充足飼糧中補充L-精胺酸(0.5%)增加了受到免疫刺激的豬血清細胞因數IL-2和IFN-γ的濃度以及生產性能(Han等,2009)。補充1%精胺酸緩解了斷奶仔豬因脂多糖激發而引起的腸道功能損傷(Liu等,2009年)。補充L-Arg(0.6%)改善了斷奶仔豬的腸道完整性和生長(Wu等,2010年)。在胺基酸以腹瀉發生率和體增重為評價指標,在胺基酸充分的飼糧中補充0.7%L-精胺酸鹽酸鹽(L-Arg×HCl)或附加1%L-麩醯胺酸改善了斷奶仔豬腸道健康(Shan等,2012;表5)。
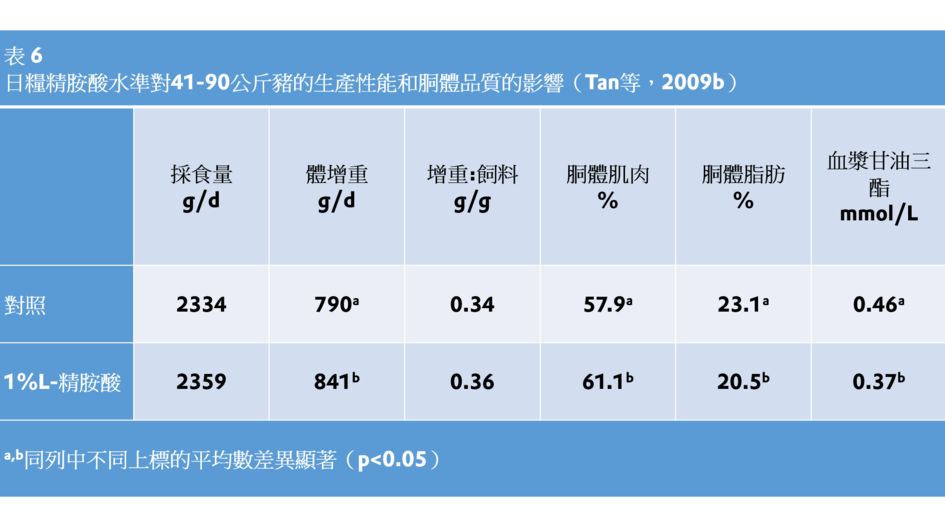
這些結果表明,補充精胺酸可以改善腸屏障功能。此外,在41-90公斤豬的飼糧中補充精胺酸(1%),提高了肌肉重量,且降低了體脂和血漿甘油三酯水準(Tan等,2009b;表6)。
補充1%L-Arg可增強豬的抗氧化能力和胴體質量(Ma等,2010)。
甘胺酸
甘胺酸參與合成絲胺酸、谷胱甘肽、肌酸、嘌呤核苷酸和血紅素等重要的分子(Kim等,2007)。甘胺酸是小腸粘膜合成谷胱甘肽的重要底物(Reeds等,1997)。甘胺酸是通過白細胞及其免疫功能調節細胞因數的產生(Zhong等,2003)。此外,甘胺酸本身是一種有效的抗氧化劑(Fang等,2002)。一項體外研究證明,在斷奶仔豬的空腸上皮細胞培養基中添加甘胺酸促進了細胞生長和蛋白質合成,並且減少了由4-羥基壬醛誘導的氧化緊迫的細胞凋亡(Wang等,2014)。
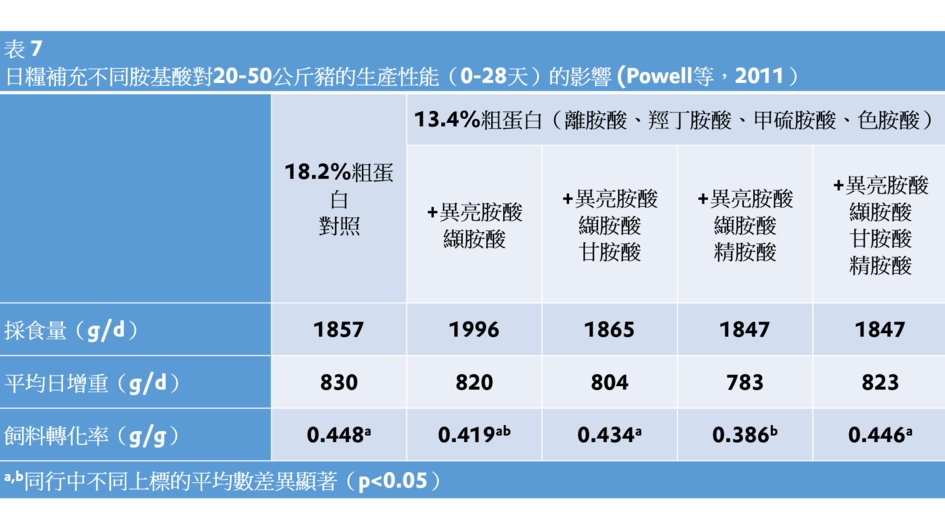
甘胺酸抑制麩醯胺酸合成酶,從而促使谷胺酸被更多地用於非必需胺基酸(NEAA)的生物合成(Tate和Meister,1971)。在額外添加了離胺酸、甲硫胺酸、羥丁胺酸、色胺酸、異亮胺酸和纈胺酸的玉米-大豆粕型低蛋白飼糧中補充甘胺酸或甘胺酸+精胺酸(相當於高蛋白飼糧水準),使20-50公斤豬的生產性能恢復到與飼喂陽性對照飼糧的相似的水準(Powell等,2011;表7),表明甘胺酸是一個合成體蛋白質的重要胺基酸。
總之,胺基酸,除了參與生長,還參與包括調節機體免疫系統的功能在內的許多重要代謝途徑。這意味著一些關鍵的胺基酸,如甲硫胺酸+半胱胺酸、色胺酸和羥丁胺酸,會被優先用於合成參與免疫應答的物質,其結果減緩動物機體的生長。關鍵胺基酸用途的轉向意預示,應該在飼糧中增加這些胺基酸供給以便維持最佳的免疫力和緩解對動物生產性能的負面影響。
此外,提高飼糧羥丁胺酸、精胺酸、麩醯胺酸和甘胺酸水準有益於增強處於亞臨床疾病狀態動物的免疫力和維持腸道的完整性。
在未來的研究,注意力應放在定量評估這些功能性胺基酸在次優條件下飼養豬的免疫狀態、腸道健康和生產性能的需求量以及它們的相互或協同作用。
縮寫
胺基酸
平均日增重
抗生素促生長劑
急性期緊迫蛋白
精胺酸
體重
半胱胺酸
歐盟
飼料轉化率
分數合成率
胃腸道
麩醯胺酸
谷胺酸鹽
甘胺酸
白細胞介素
免疫系統刺激
脂多糖
甲硫胺酸
雷帕黴素的哺乳動物靶點
氮
一氧化氮
門脈流經的內藏器官
活性氧物質
硫
含硫胺基酸
標準回腸可消化的
羥丁胺酸
腫瘤壞死因數
色胺酸
更多資訊
Bertolo, R. F., C. Z. Chen, G. Law, P. Pencharz, and R. O. Ball. 1998. Threonine requirement of neonatal piglets receiving total parenteral nutrition is considerably lower than that of piglets receiving an identical diet intragastrically. Journal of Nutrition 128:1752 – 1759.
Bikker, P., J. Fledderus, L. Le Bellego, and M. Rovers. 2007. Growth response of pigs to dietary threonine:lysine ratio is affected by the withdrawal of antimicrobial growth promoters. European Association for Animal Production 124:557 – 560.
Blecha, F. 2001. Immunology. Pages 688711 in Biology of the Domestic Pig. W. G. Pond and H. J. Mersmann, ed. Cornell Univ. Press, Ithaca, NY.
Botting, N. P. 1995. Chemistry and neurochemistry of the kynurenine pathway of tryptophan metabolism. Chemical Society Reviews 24:401 – 412.
Bowland, J. P. 1966. in: L. K. Bustad, R. O. McClellan and M.P. Burns (Ed.): Swine in biomedical research, Frayn, USA.
Capozzalo, M. M., J.C. Kim, J.K. Htoo, C.F.M. de Lange, B.P. Mullan, J.W. Resink, C.F. Hansen, P.A. Stumbles, D.J. Hampson, N. Ferguson, and J.R. Pluske. 2013. A tryptophan:lysine ratio of 0.24 gives optimum performance of weaner pigs under commercial conditions. Manipulating Pig Production XIV. Proceedings of the Fourteenth Biennial Conference of the Australasian Pig Science Association, November 24 – 27, 2013, Melbourne, Australia. p. 91.
Capozzalo, M. M., J. W. Resink, J. K. Htoo, J. C. Kim, C. F. M. de Lange, and C. F. Hansen. 2014. Optimum sulfur amino acid to lysine ratio for weaner pigs infected with enterotoxigenic E. coli. Journal of Animal Science 92 (Suppl. 2):40. (Abstr.).
Capozzalo, M. M., J. C. Kim, J. K. Htoo, C. F.M. de Lange, B. P. Mullan, C. F. Hansen, JW. Resink, P. A. Stumbles, D. J. Hampson, and J. R. Pluske. 2015. Effect of increasing the dietary tryptophan to lysine ratio on plasma levels of tryptophan, kynurenine and urea and on production traits in weaner pigs experimentally infected with an enterotoxigenic strain of Escherichia coli. Archives of Animal Nutrition 69(1):17 – 29.
Chen, H., J. Lin, H. Fung, L. Ho, P. Yang, W. Lee, Y. Lee, and R. Chu. 2003. Serum acute phase proteins and swine health status. Canadian Journal of Veterinary Research 67: 283 – 290.
Colditz, I. G. 2002. Effects of the immune system on metabolism: implications for production and disease resistance in livestock. Livestock Pro duction Science 75:257 – 268.
Cuaron, J. A., R. P. Chapple, and R. A. Easter. 1984. Effect of lysine and threonine supplementation of sorghum gestation diets on nitrogen balance and plasma constituents in first-litter gilts. Journal of Animal Science 58:631 – 637.
CunninghamRundles, S. (2002): Evaluation of the effects of nutrients on immune function. Pages 57 – 92 in: Calder P.C., Field C.J., Gill H. S. (eds.) Nutrition and immune function. CABI Publishing. Wallingford, UK.
de Abreu, M. L. T., J. L. Donzele, A. Saraiva, R. F. M. de Oliveira, E. L. Fortes, and G. L. L. Graña. 2010. Glutamine, nucleotides and swine plasma in diets for weaned piglets. Revista Brasileira de Zootecnia 39(3):520 – 525.
de Jonge, W. J., K. L. Kwikkers, A. A. Te Velde, S. J. H. van Deventer, M. A. Nolte, R. E. Mebius, J. M. Ruijter, M. Lamers, and W. H. Lamers. 2002. Arginine deficiency affects early B cell maturation and lymphoid organ development in transgenic mice. Journal of Clinical Investigation 110:1539 – 1548.
de Ridder, K., C. L. Levesque, J. K. Htoo, and C. F. M. de Lange. 2012. Immune system stimulation reduces the efficiency of tryptophan utilization for body protein deposition in growing pigs. Journal of Animal Science 90:3485–3491.
Dwyer, D. S. 1979. Regulation of the immune response by polyamines. Medical Hypotheses 5:1169 – 1181.
Fang, Y. Z., S. Yang, and G. Wu. 2002. Free radicals, antioxidants, and nutrition. Nutrition 8, 872 – 879.
Galli, F. 2007. Amino acid and protein modification by oxygen and nitrogen species. Amino Acids 32:497 – 499.
Grimble, R. F. 2002. Sulphur amino acids, glutathione and immune function. Pages 133 – 150 in: Nutrition and Immune Function; Calder PC, Field CJ, Gill HS. (eds.); CABI Publishing: New York, NY, USA.
Hamard, A., B. Seve, and N. Le Floch. 2007. Intestinal development and growth performance of early-weaned piglets fed a low-threonine diet. Ani mal 1:1134 – 1142.
Han, J., Y. L. Liu, W. Fan, J. Chao, Y. Q. Hou, Y. L. Yin, H. L. Zhu, G. Q. Meng, and Z. Q. Che. 2009. Dietary L-arginine supplementation alleviates immunosuppression induced by cyclo phosphamide in weaned pigs. Amino Acids 37:643651.
Hsu, C. B., S. P. Cheng, J. C. Hsu, and H. T. Yen. 2001. Effect of threonine addition to a low protein diet on IgG levels in body fluid of first litter sows and their piglets. Asian-Australian Journal of Animal Science 14:11571163.
Hunter, E. A. and R. F. Grimble. 1994. Cysteine and methionine supplementation modulate the effect of tumour necrosis factor alpha on protein syn thesis, glutathione and zinc concentration of liver and lung in rats fed a low protein diet. Journal of Nutrition 124(12):23192328.
Jahoor, F., L. Wykes, M. Del Rosario, M. Frazer and P. J. Reeds. 1999. Chronic protein undernutrition and an acute inflammatory stimulus elicit different protein kinetic responses in plasma but not in muscle of piglets. Journal of Nutrition 129:693 – 699.
Jayaraman, B., J. K. Htoo, and C.M. Nyachoti. 2014. Effects of dietary threonine:lysine ratio and sanitary conditions on performance and plasma urea nitrogen of weaned pigs fed antibiotic-free diets. Journal of Animal Science 92(ESuppl. 1):218. (Abstr.).
Jayaraman, B., J. K. Htoo, and C.M. Nyachoti. 2015. Effects of increasing standardized ileal digestible tryptophan:lysine ratio on performance and ileal expression of cytokine mRNA in weaned pigs challenged with Escherichia coli K88. Journal of Animal Science 93 (Suppl. S3):201 – 202. (Abstr.).
Kampman-van de Hoek, E. 2015. Impact of health status on amino acid requirements of growing pigs. Towards feeding strategies for farms differing in health status. PhD thesis. Wageningen University, Wageningen. The Netherlands.
Kim, S. W., R. D. Mateo, G. Wu, J. A. Carroll, and I. Shinzato. 2006. Dietary L-arginine supplementation affects immune status of pregnant gilts. Journal of the Federation of American Societies for Experimental Biology. 20:A424.
Kim, S. W., R. D. Mateo, Y. L. Yin, and G. Wu. 2007. Functional amino acids and fatty acids for enhancing production performance of sows and piglets. Asian-Australasian Journal of Animal Science 20:295 – 306.
Kim, J. C., B. P. Mullan, B. Frey, H. G. Payne, and J. R. Pluske. 2012. Whole body protein deposition and plasma amino acid profiles in growing and/or finishing pigs fed increasing levels of sulfur amino acids with and without Escherichia coli lipopolysaccharide challenge. Journal of Animal Science 90:362 – 365.
Kuby, J. 1994. Immunology. 2nd Ed. W. H. Freeman and Company. New York, New York.
Law, G. K., R. F. Bertolo, A. Adjiri-Awere, P. B. Pencharz, and R. O. Ball. 2007. Adequate oral threonine is critical for mucin production and gut function in neonatal piglets. American Journal of PhysiologyGastrointestinal and Liver Physiology 292:G1293G1301.
Le Floc’h, N. and B. Seve. 2007. Bio logical roles of tryptophan and its metabolism. Potential implications for pig feeding. Livestock Science 112:23 – 32.
Le Floc’h, N., D. Melchior, L. Le Bellego, J. J. Matte, and B. Sève. 2007. Does sanitary status have an effect on tryptophan requirement for growth of postweaning piglets? (in French, with English abstract). Journees Rech. Porcine en France 39:125 – 132.
Le Floc’h, N., D. Melchior, and B. Seve. 2008. Dietary tryptophan helps pre serve tryptophan homeostasis in pigs suffering from lung inflammation. Journal of Animal Science 86:3473 – 3479.
Li, D. F., C. T. Xiao, S. Y. Qiao, J. H. Zhang, E. W. Johnson, and P. A. Thacker. 1999. Effects of dietary threonine on performance, plasma parameters and immune function of growing pigs. Animal Feed Science and Technology 78:179 – 188.
Li, P., YL. Yin, D. Li, S. W. Kim, and G. Wu. 2007. Amino acids and immune function. British Journal of Nutrition 98:237252.
Lien, K. A., W. C. Sauer, and M. Fenton. 1997. Mucin output in ileal digesta of pigs fed a protein-free diet. Zeitschrift für Ernährungswissenschaft 36:182–190.
Litvak, N., J. K. Htoo, and C. F. M. de Lange. 2013a. Restricting sulfur amino acid intake in growing pigs challenged with lipopolysaccharides decreases plasma protein and albumin synthesis. Canadian Journal of Animal Science 93:505 – 515.
Litvak, N., A. Rakhshandeh, J. K. Htoo, and C. F. M. de Lange. 2013b. Immune system stimulation increases the optimal dietary methionine to methionine plus cysteine ratio in growing pigs. Journal of Animal Science 91:4188 – 4196.
Liu, Y., J. Han, J. Huang, X. Wang, F. Wang, and J. Wang. 2009. Dietary L-arginine supplementation improves intestinal function in weaned pigs after an Escherichia coli lipopolysaccharide challenge. Asian-Australasian Journal of Animal Science 22(12):1667 – 1675.
Liu, T., J. Peng, Y. Xiong, S. Zhou, and X. Cheng. 2002. Effects of dietary glutamine and glutamate supplementation on small intestinal structure, active absorption and DNA, RNA concentrations in skeletal muscle tissue of weaned piglets during d 28 to 42 of age. Asian-Australasian Journal of Ani mal Science 15(2):238 – 242.
Lu, S. C. 2009. Regulation of glutathione synthesis. Molecular Aspects of Medicine 30:42 – 59.
Ma, X., Y. Lin, Z. Jiang, C. Zheng, G. Zhou, D. Yu, T. Cao, J. Wang, and F. Chen. 2010. Dietary arginine supplementation enhances antioxidative capacity and improves meat quality of finishing pigs. Amino Acids 38:95 – 102.
Mathai, J. K., J. K. Htoo, J. Thomson, K. J. Touchette, and H. H. Stein. 2015. Effects of dietary fiber on the optimum threonine:lysine ratio for 25 to 50kg gilts. Journal of Animal Science 93 (Suppl. s3):298. (Abstr.).
Mayer, L. 2000. Mucosal immunity and gastrointestinal antigen processing. Journal of Pediatric Gastroenterology and Nutrition 30(Suppl.):S4 – S12.
Melchior, D., B. Sève, and N. Le Floc’h. 2004. Chronic lung inflammation affects plasma amino acid concentrations in pigs. Journal of Animal Science 82:1091 – 1099.
Moeser, A. J., Klok, C. V., Ryan, K. A., Wooten, J. G., Little, D., Cook, V. L., and A. T. Blikslager. 2007. Stress signaling pathways activated by weaning mediate intestinal dysfunction in the pig. American Journal of PhysiologyGastrointestinal and Liver Physiology 292:G173 – G181.
Molino, J. P., J. L. Donzele, R. F. M. de Oliveira, A. Saraiva, D. Haese, E. L. Fortes, and M. F. de Sauza. 2012. L-glutamine and L-glutamate in diets with different lactose levels for piglets weaned at 21 days of age. Revista Brasileira de Zootecnia 41(1):98 – 105.
Myrie, S. B., R. F. Bertolo, W. C. Sauer, and R. O. Ball. 2008. Effect of common antinutritive factors and fibrous feedstuffs in pig diets on amino acid digestibility with special emphasis on threonine. Journal of Animal Science 86:609 – 619.
NRC, 2012. Nutrient Requirements of Swine. 11th ed., Washington D.C. USA.
Obled, C. 2003. Amino acid requirements in inflammatory states. Canadian Journal of Animal Science 83(3):365 – 373.
Oswald, I. P. 2006. Role of intestinal epithelial cells in the innate immune defense of the pig intestine. Veterinary Research 37:359 – 368.
Parkin, J. and B. Cohen. 2001. An overview of the immune system. Lancet 357:1777 – 1789.
Pastorelli, H., J. van Milgen, P. Lovatto, and L. Montagne. 2012. Meta-analysis of feed intake and growth responses of growing pigs after a sanitary challenge. Animal 6:952 – 961.
Pluske, J. R., Hampson, D. J., and I. H. Williams. 1997. Factors influencing the structure and function of the small intestine in the weaned pig: a review. Live stock Production Science 51:215 – 236.
Powell, S., T. B. Bidner, R. L. Payne, and L. L. Southern. 2011. Growth performance of 20 to 50kilogram pigs fed low-crudeprotein diets supplemented with histidine, cystine, gly cine, glutamic acid, or arginine. Journal of Animal Science 89:3643 – 3650.
Rakhshandeh, A., J. K. Htoo, and C. F. M. de Lange. 2010. Immune system stimulation of growing pigs does not alter apparent ileal amino acid digestibility but reduces the ratio between whole body nitrogen and sulfur retention. Livestock Science 134:21 – 23.
Rakhshandeh, A., J. K. Htoo, N. Karrow, S. P. Miller, and C. F. M. de Lange. 2014. Impact of immune system stim ulation on ileal nutrient digestibility and utilization of methionine plus cysteine intake for whole body protein deposition in growing pigs. British Journal of Nutrition 111:101 – 110.
Reeds, P. J., D. G. Burrin, B. Stoll, F. Jahoor, L. Wykes, J. Henry, and M. E. Frazer. 1997. Enteral glutamate is the preferential source for mucosal glutathione synthesis in fed piglets. American Journal of Physiology 273:E408 – E415.
Reeds, P. J. and F. Jahoor. 2001. The amino acid requirements of disease. Clinical Nutrition 20 (S1):15 – 22.
Roth, E. 2007. Immune and cell modulation by amino acids. Clinical Nutrition 26:535 – 544.
Shan, Y., A. Shan, J. Li, and C. Zhou. 2012. Dietary supplementation of arginine and glutamine enhances the growth and intestinal mucosa development of weaned piglets. Livestock Science 150:369 – 373.
Shao, L., Serrano D. and L. Mayer. 2001: The role of epithelial cells in immune regulation in the gut. Seminars in Immunology 13:163 – 176.
Stadnyk A.W. 2002. Intestinal epithelial cells as a source of inflammatory cytokines and chemokines, Canadian Journal of Gastroenterology 16:241 – 246.
Stipanuk, M. H. and I. Ueki. 2011. Dealing with methionine/homocysteine sulfur: cysteine metabolism to taurine and inorganic sulfur. Journal of Inherited Metabolic Diseases 34(1):17 – 32.
Stoll, B. and D. G. Burrin. 2006. Measuring splanchnic amino acid metabolism in vivo using stable isotopic tracers. Journal of Animal Science 84(Suppl. 13):E60 – 72.
Stoll, B., J. Henry, P. J. Reeds, H. Yu, Jahoor, and D. G. Burrin. 1998. Catabolism dominates the first-pass intestinal metabolism of dietary essential amino acids in milk protein-fed pig lets. Journal of Nutrition 128:606 – 614.
Strous, G. J. and J. Dekker. 1992. Mucintype glycoproteins. Critical review in Biochemistry and Biology 27:57 – 92.
Tan B., X.G. Li, X. Kong, R. Huang, Z. Ruan, K. Yao, Z. Deng, M. Xie, I. Shinzato, Y. Yin, and G. Wu. 2009a. Dietary L-arginine supplementation enhances the immune status in earlyweaned piglets. Amino Acids 37:323 – 331.
Tan, B., Yin Y., Z. Liu, X. Li., H. Xu., X. Kong, R. Huang, W. Tang, I. Shinzato, S. B. Smith, and G. Wu. 2009b. Dietary L-arginine supplementation increases muscle gain and reduces body fat mass in growing-finishing pigs. Amino Acids 37:169 – 175.
Tan, B., M. Xie and Y. Yin. 2013. Amino acids and immune functions. Pages 175185 in: Nutritional and Physiological Functions of Amino Acids in Pigs. Eds. F. Blachier, G. Wu and Y. Yin. Heidelberg, Germany: Springer.
Tate, S. S. and A. Meister. 1971. Regulation of rat liver glutamine synthase: Activation by αketoglutarate and inhibition by glycine, alanine, and carbamyl phosphate. Proceedings of the National Academy of Sciences of the United States of America 68:781 – 785.
Visek, W. J. 1986. Arginine needs, physiological states and usual diets. A reevaluation. Journal of Nutrition 116:36 – 46.
Wang, X., S. Y. Qiao, M. Liu, and X. Ma. 2006. Effects of graded levels of true ileal digestible threonine on performance, serum parameters and immune function of 10 – 25 kg pigs. Animal Feed Science and Technology 129:264 – 278.
Wang, X., S. Y. Qiao, Y. L. Yin, L. Yue, Wang, and G. Wu. 2007. A deficiency or excess of dietary threonine reduces protein synthesis in jejunum and skeletal muscle of young pigs. Journal of Nutrition 137:1442 – 1446.
Wang, J. J., L. X. Chen, P. Li, X. L. Li, H. J. Zhou, F. L. Wang, D. F. Li , Y. L. Yin, and G. Wu. 2008. Gene expression is altered in piglet small intestine by weaning and dietary glutamine supplementation. Journal of Nutrition 138:1025 – 1032.
Wang, W., Z. Wu., G. Lin., S. Hu, B. Wang, Z. Dai, and G. Wu. 2014. Glycine stimulates protein synthesis and inhibits oxidative stress in pig small intestinal epithelial cells. Journal of Nutrition 144(10):1540 – 1548.
Widner, B., M. Ledochowski, and D. Fuchs. 2000. Interferon-gamma induced tryptophan degradation: neuropsychiatric and immunological con sequences. Current Drugs Metabolism 1:193 – 204.
Wu, G., S. A. Meier, and D. A. Knabe. 1996. Dietary glutamine supplementation prevents jejunal atrophy in weaned pigs. Journal of Nutrition 126: 2578 – 2584.
Wu, G. 1998. Intestinal mucosal amino acid catabolism. Journal of Nutrition 128:1249 – 1252.
Wu, G. Y. and S. M. Jr. Morris. 1998. Arginine metabolism: nitric oxide and beyond. Biochemical Journal 336:1 – 17.
Wu, G., Y. Fang, S. Yang, J. R. Lupton, and N. D. Turner. 2004. Glutathione metabolism and its implications for health. Journal of Nutrition 134:489 – 492.
Wu, G., W. B. Fuller, T. A. Davis, L. A. Jaeger, G. A. Johnson, S. W. Kim, D. A. Knabe, C. J. Meininger, T. E. Spencer, and YL Yin. 2007. Important roles for the arginine family of amino acids in swine nutrition and production. Livestock Science 112:8 – 22.
Wu, G. 2009. Amino acids: metabolism, functions, and nutrition. Amino Acids 37:1 – 17.
Wu, G. 2010. Functional amino acids in growth, reproduction, and health. Advances in Nutrition 1:31 – 37.
Wu, X., Z. Ruan, Y. Gao, Y. Yin, X. Zhou, L. Wang, M. Geng, Y. Hou, and G. Wu. 2010. Dietary supplementation with L-arginine or N-carbamylglutamate enhances intestinal growth and heat shock protein70 expression in weanling pigs fed a corn and soybean meal-based diet. Amino Acids 39:831 – 839.
Yao K, Y. L. Yin, W. Y. Chu, Z. Liu, D. Deng, T. Li, R. Huang, J. Zhang, B. Tan, W. Wang, and G. Wu. 2008. Dietary arginine supplementation increases mTOR signaling activity in skeletal muscle of neonatal pigs. Jour nal of Nutrition 138:867 – 872.
Yoneda, J., A. Andou, and K. Takehana. 2009. Regulatory roles of amino acids in immune response. Current Rheumatology Reviews 5:252 – 258.
Yoo, S. S., C. J. Field, and M. I. McBurney. 1997. Glutamine supple mentation maintains intramuscular glutamine concentrations and normalizes lymphocyte function in infected early weaned pigs. Journal of Nutrition 127:2253 – 2259.
Zhang, G. J., Q. L. Song, C. Y. Xie, C. Chu, P. A. Thacker, J. K. Htoo, and S. Y. Qiao. 2012. Estimation of the ideal ratio of standardized ileal digestible tryptophan to lysine for growing pigs fed low crude protein diets supplemented with crystalline amino acids. Livestock Science 149:260 – 266.
Zhang, G. J., P.A. Thacker, J.K. Htoo, and S.Y. Qiao. 2015. Optimum pro portion of standardized ileal digestible sulfur amino acid to lysine to maximize the performance of 25–50 kg growing pigs fed reduced crude protein diets fortified with amino acids. Czech Journal of Animal Science 60(7):302 – 310.
Zhong, Z., M. D. Wheeler, X. L. Li, M. Froh, P. Schemmer, M. Yin, H. Bunzendaul, B. Bradford, and J. J. Lemasters. 2003. Glycine: a novel anti-inflammatory, immunomodulatory, and cytoprotective agent. Current Opinion in Clinical Nutrition and Metabolic Care 6:229 – 240.
Zhu, C. L., M. Rademacher, and C. F. de Lange. 2005. Increasing dietary pectin level reduces utilization of digestible threonine intake, but not lysine intake, for body protein deposition in growing pigs. Journal of Animal Science 83:1044 – 1053.
Zou, X. T., G. H. Zheng, X. K. J. Fang, and J. F. Fang. 2006. Effects of glutamine on growth performance of weanling piglets. Czech Journal of Animal Science 51(10)
